DALTON
John DALTON (1766-1844), chimiste britannique. Il a étudié sur lui même les troubles de la perception des couleurs appelés le daltonisme.
Composition de l’air 20 % O2 et 80 % N2
Rappel :
Mariotte P x V = C (gaz parfait )
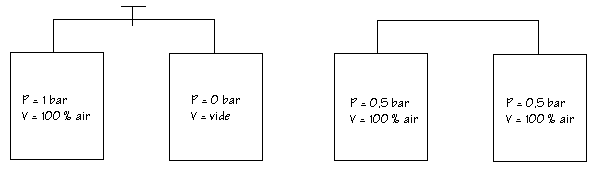
Comportement d’un mélange gazeux comme l’air face à la loi de Mariotte

Après ouverture du robinet l'air passe dans l'autre cuve est la remplie entièrement. La pression chute de moitié. Le volume augmente par 2, la pression diminue par 2. La loi de Mariotte s'applique au mélange gazeux
Comportement d’un gaz parfait au sein d’un mélange
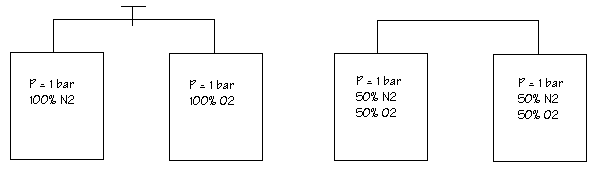
Nous constatons que la pression n'a pas chuté et que les gaz se mélangent .Ils se comportent comme s'ils étaient seuls.
Un mélange gazeux obéit aux même lois physiques qu’un gaz parfait.
A température constante, la pression absolue d’un mélange gazeux est égale à la somme des pressions partielles des gaz qui le compose.
Pression partielle = Pression absolue x % du gaz utilisé
Pp = Pabs x %
Pp de N2 à 40 m est de ?
40 m = 5 b
% de l'azote dans l'air = 80%
Pp = 5 x 80%
Pp = 5 x 0,8 = 4 b
Pp de O2 est de 1,7 b quelle est la profondeur ?
% de L'oxygène est de 20 %
1,6 b = Pabs x 20%
Pabs = 1,6 : 20%
Pabs = 1,6 : 0,2 = 8 bar = 70 m
Accident biochimique, ( Narcose ).
Adaptation des tables MN 90 pour d’autres mélanges que l'air,( Plongée Nitrox ).